ALCOHOLES
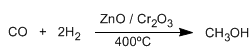
El metanol es un líquido incoloro, su punto de ebullición es 65ºC, miscible en agua en todas las proporciones y venenoso (35 ml pueden matar una persona)
La mitad del metanol producido se oxida a metanal (formaldehído), material de partida para la fabricación de resinas y plásticos.
El etanol se obtiene por fermentación de materia vegetal, obteniéndose una concentración máxima de 15% en etanol. Por destilación se puede aumentar esta concentración hasta el 98%.
También se puede obtener etanol por hidratación del etileno (eteno) que se obtiene a partir del petróleo.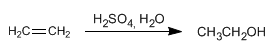
El etanol es un líquido incoloro, miscible en agua en todas proporciones, con punto de ebullición de 78ºC. Es fácilmente metabolizado por nuestros organismos, aunque su abuso causa alcoholismo.
CLASIFICACIÓN
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo del carbono funcional al que se una el grupo hidroxilo.
- Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: se obtiene una cetona + agua.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
- Trialcohol o triol: Cuando presenta tres hidroxilo.
- Polialcohol poliol: Cuando presenta cuatro o más hidroxilos.
PROPIEDADES FISICAS DE LOS ALCOHOLES
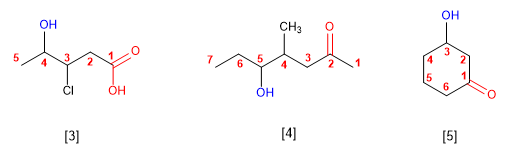
NOMENCLATURA

FENOLES
Los fenoles son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH.
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.
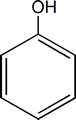
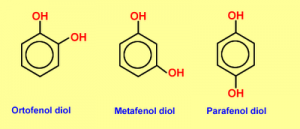
Si existen 2, 3 o más grupos OH se denominaran difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo estan vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si estan en lados opuestos para (p).
El fenol no existe en estado libre.
Se forma en la destilación seca de la hulla. Luego se destilan los aceites medios del alquitrán de hulla.
Por este método se obtiene poca cantidad. Por este motivo se lo prepara hoy sintéticamente.
A partir de la formación del ácido bencenosulfónico:
En la primera etapa el benceno reacciona con el ácido sulfúrico:
Este ácido formado después reacciona con el sulfito de sodio, dando como producto bencenosulfonato de sodio.
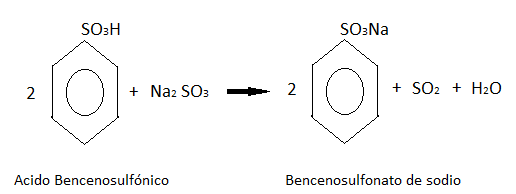
El bencenosulfonato de sodio después se concentra por evaporación y se combina con hidróxido de sodio.
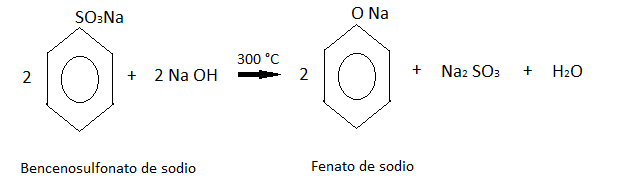
Este último producto se acidifica con dióxido de azufre de una de las reacciones anteriores, obteniendo finalmente al fenol.
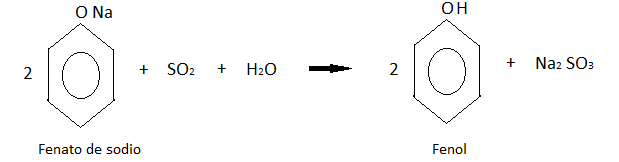
Propiedades del Fenol:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
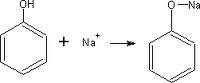
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.
Usos del Fenol: Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
ÉTERES
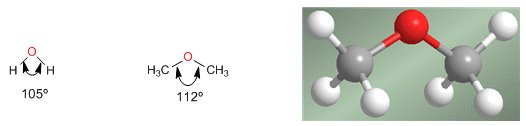
NOMENCLATURA
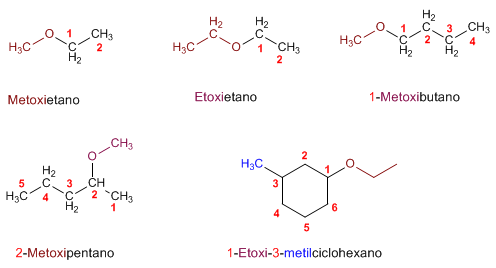
Regla 2. La nomenclatura funcional (IUPAC) nombra los éteres como derivados de dos grupos alquilo, ordenados alfabéticamente, terminando el nombre en la palabra éter.
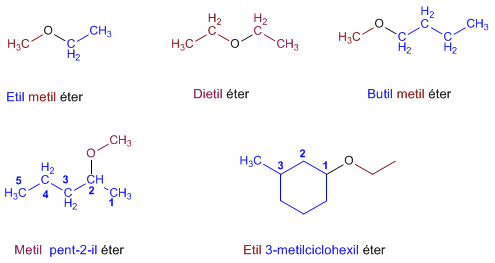
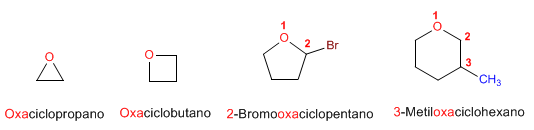
Regla 3. Los éteres cíclicos se forman sustituyendo un -CH2- por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefio oxa- seguido del nombre del ciclo.
TIOLES
NOMENCLATURA
Cuando un grupo tiol es un sustituyente de un alcano, hay varias formas de nombrar al tiol resultante:
- El método preferido (utilizado por la IUPAC) consiste en añadir el sufijo -tiol al nombre del alcano. El método es casi idéntico a la denominación de alcoholes. Ejemplo: CH3SH sería metanotiol.
- Un viejo método, la palabra mercaptano sustituye alcohol en el nombre del compuesto equivalente de alcohol. Ejemplo: CH3SH sería metil mercaptán.
- Como prefijo, el término utilizado es mercapto. Ejemplo: mercaptopurina
Nomenclatura de Sulfuros
Los sulfuros on el equivalente de los éteres pero con un átomo de azufre en lugar de oxígeno, por tanto, presentan la agrupación R-S-R’, siendo simétricos cuando R=R’. Se nombran de forma análoga a los éteres.
Se puede emplear la nomenclatura sustitutiva mediante los prefijos alquiltio– o ariltio-, o bien la nomenclatura radical-función empleando la palabra sulfuro en lugar de éter, o la palabra tio– para los compuestos simétricos.
ejercicios
eteres:
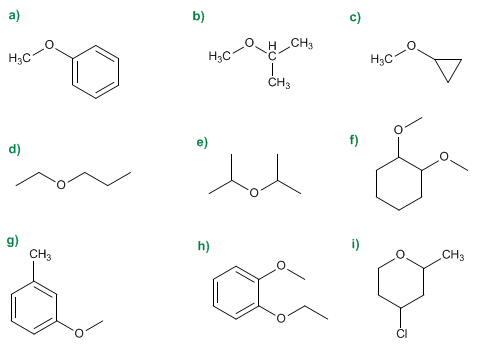
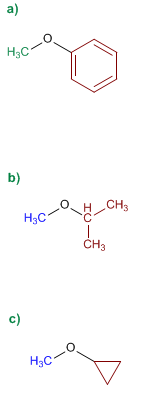
1. Sustituyentes: fenil y metil
2. Nombre: Fenil metil éter
1. Sustituyentes: isopropil y metil
2. Nombre: Isopropil metill éter
2. Nombre: Ciclopropil metil éter
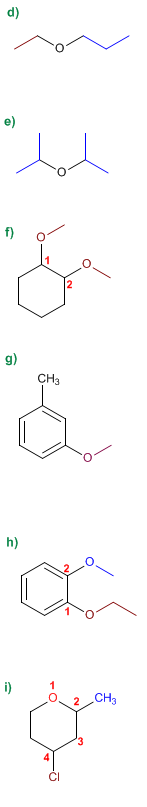
1. Sustituyentes: etilo y propilo
2. Nombre: Etil propil éter
1. Sustituyentes: isopropilos
2. Nombre: Diisopropil éter
2. Numeración: otorga localizadores más bajos a sustituyentes
3. Sustituyentes: metoxidos en 1,2
4. Nombre: 1,2-Dimetoxiciclohexano
2. Numeración: metilo y metóxido en meta.
3. Sustituyentes: metoxido
4. Nombre: m-Metoxitolueno
2. Numeración: Comienza en el etoxi (antes alfabéticamente)
3. Sustituyentes: etoxido en 1 y metoxido en 2. (posición meta)
4. Nombre: m-Etoximetoxibenceno
1. Cadena principal: ciclo de 6 miembros (oxaciclohexano)
2. Numeración: comienza en el oxígeno, prosigue a la derecha para otorgar a los sustituyentes los menores localizadores.
3. Sustituyentes: cloro y metilo
4. Nombre: 4-Cloro-2-metiloxaciclohexano

Ejercicio 1
Nombres IUPAC:
4- metil- 1,2- difenol
1,2- dihidroxi- 4 metilbenceno
Nombres Común:
2-hidroxi- para-cresol
4-metilcatecol
Ejercicio 2
Nombres IUPAC:
1,3- difenol
1,3- dihidroxibenceno
Nombres Común:
Resorcinol
Meta-fenol
Ejercicio 3
Nombres:
3- etilfenol
3- etil- 1 hidroxibenceno
Ejercicio 4
Nombres IUPAC:
5- etil-1,3- difenol
5-etil-1,3- dihidroxibenceno
Nombres Común:
5-etilResorcinol
ALCOHOLES:
- CH3-OH
- CH3-CH2-OH

3.


4.

5.
6.



9.
10.

RESPUESTAS
1. IUPAC: Metanol 2. IUPAC: Etanol 3. IUPAC: 1-propanol
Común: Alcohol metílico Común: Alcohol etílico Común: Alcohol n-propílico
4. IUPAC: 2-propanol 5. IUPAC: 5,5-dimetil-1-hexanol.
Común: Alcohol isopropílico Común: Alcohol neooctílico
6. IUPAC: 3,5-dimetil-4-heptanol 7. IUPAC: 4-Penten-2-ol
Común: no tiene nombre Común: no tiene nombre
Común: no tiene nombre Común: Alcohol ciclohexílico
10. IUPAC: Ciclohex-2-en-1-ol
También es correcto:2-ciclohexen-1-ol
Común: Alcohol ciclohexenílico
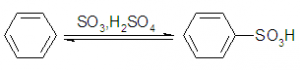
Faltaron los sulfuros
ResponderBorrar