REACCIONES QUÍMICAS
Las reacciones químicas son el proceso de arreglo de átomos y enlaces cuando sustancias químicas entran en contacto. Las propiedades químicas cambian al alterar el arreglo de los átomos en esa sustancia. Las sustancias químicas que cambian son los reactantes y las nuevas sustancias que se forman o aparecen son los productos:
Las ecuaciones químicas muestran cuales son los reactantes, los productos y otros participantes como catalizadores y energía. Los reactantes se anotan a la izquierda de la flecha que apunta a los productos, de esta forma:
Esto se lee de la siguiente manera: una molécula de gas metano reacciona con 2 moléculas del oxígeno para formar una molécula de dióxido de carbono gaseoso y dos moléculas de vapor de agua. El oxígeno y el metano son los reactantes, el dióxido de carbono y el agua son productos.
CARACTERISTICAS:
- Pueden ser reversibles o irreversibles: Si los productos pasan a ser reactantes, se dice que la reacción es reversible. Si en cambio, cuando los productos no vuelven a formar los reactantes que les dieron origen, se habla de reacciones irreversibles. Por ejemplo, cuando se transforma el azúcar en caramelo al calentarlo, por mas que enfriemos el caramelo es imposible que este vuelva a transformarse en azúcar.
- Los átomos no cambian: en una reacción química, los átomos siguen siendo los mismos, lo que cambia es la forma como están unidos entre ellos.
- La mayoría de la reacciones que ocurren en los organismos tienen lugar en soluciones acuosas, esto es, las sustancias están disueltas en el agua.
- Pueden ser simples, requieren solo un paso para que los reactantes se transformen en productos. Otras reacciones son más complejas, por lo que presentan varios pasos entre reactantes y productos. Entre los pasos, se pueden formar compuestos intermediarios, que no son ni reactantes ni productos.
- La cantidad de átomos en los reactantes es igual a la cantidad de átomos en los productos.
Los carbocationes se clasifican como primarios, secundarios o terciarios, de acuerdo con el carbono portador de la carga positiva. Se nombran utilizando la palabra catión. estos los grupos de +I lo estabilizan.
CARBANIONES: Un carboanión es una especie molecular orgánica con una carga eléctrica negativa ubicada en un átomo de carbono. En otras palabras, es un anión en el que un átomo de carbono posee un par de electrones no compartidos con tres sustituyentes. estos los de -I lo estabilizan.
TIPOS DE REACTIVOS
NUCLEÓFILOS: tienen uno o mas pares de electrones libres. (bases de Lewis), estos atacan a partes de moleculas con deficiencia de electrones.
ELECTRÓLIFOS: tienen orbitales externos vacios. (ácidos de Lewis), estos atacan a zonas con alta densidad electronica.
REACCIONES QUIMICAS PRINCIPALES
- SUSTITUCIÓN
- ADICIÓN
- ELIMINACION
- REDOX
REACCIONES DE SUSTITUCIÓN
- RADICÁLICA: se produce en 3 fases: iniciacion, propagacion, terminacion
INICIACION: -Cl2 + luz ultravioleta = 2Cl.
PROPAGACION: -CH3-CH3-CL = CH3-CH2 + HCL
TERMINACIÓN: -CH3-CH2 + Cl = CH3-CH2-Cl
- ELECTRÓFILA: un reactivo eletrófilo ataca zonas de alta densidad electronica.
2.1 halogenacion
- NUCLEOFILA
- electrofila
- nucleofila
- radicálica
2.1 nucleofilica
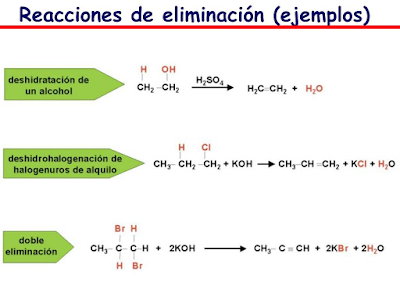
- REACCIONES DE ELIMINACION
- REACCIONES REDOX
En las reacciones de óxido-reducción o también llamadas reacciones redox hay transferencia de electrones entre los reactantes. Esto transforma los estados de oxidación de los elementos o compuestos. La corrosión de los herramientas de hierro es un ejemplo clásico de reacción de oxido-reducción.
Oxidación se refiere a la pérdida de electrones, reducción se refiere a la ganancia de electrones. Un agente oxidante es la especie o sustancia que oxida otra especie, reduciéndose en el proceso. Un agente reductor es la especie que reduce otra especie, oxidándose en el proceso.
En este caso, el sulfuro de hidrógeno (H2S) es el agente reductor mientras que el cloro (Cl2) es el agente oxidante.
REACCIONES REDOX MAS COMUNES:
- oxidacion de alquenos
- ozonolisis
- oxidacion de alcoholes
- oxidacion y reduccion de aldehidos y cetonas
- combustion
2. OZONOLISIS: es una reaccion especifica del doble enlace, que consiste en la ruptura del mismo partiendo la cadena en dos y formando ácidos carboxilicos o cetonas.
- Los aldehídos son sustancias muy frágiles y reductoras y se oxidan con facilidad a ácidos
- Los aldehídos también pueden transformarse en alcoholes primarios e incluso en hidrocarburos en presencia de un ambiente reductor fuerte, dependiendo del catalizador empleado
- En cambio, las cetonas sufren reacciones de reducción similares a los aldehídos, pero se resisten a ser oxidadas.
- ESTERIFICACION/HIDROLISIS ÁCIDA: se produce entre acidos carboxilicos cuando reaccionan con alcoholes. se forman esteres y se desprende una molecula de agua y es una reaccion reversible.
- SAPONIFICACION: es una reaccion de las grasas y esta no es reversible.
- CONDENSACION:




Revisado
ResponderBorrar